如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高正价是最低负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
(1)写出B、D、E最高氧化物对应水化物的化学式:______、______、______.其中酸性最强的是______
(2)写出A、B、C所形成气态氢化物的化学式:______、______、______.其中最稳定的是______.
(3)D和E组成的一种化合物,化合物中各原子最外层都满足8电子结构,这种化合物的电子式是______.
(4)写E的单质与B的氢化物反应的化学方程式______.
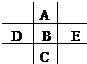
B元素的最高正价是最低负价绝对值的3倍,则最高正价为+6价,它的最高氧化物为BO3,其中含氧60%,设B的相对原子质量为M,则有
×100=40%,M=32,则B为S元素,A为O元素,D为P元素,E为Cl元素,C为Se元素,M M+3×16
(1)B、D、E最高氧化物对应水化物分别为:H2SO4、H3PO4、HClO4,同周期元素从左到右元素的非金属性逐渐增强,对应最高价氧化物的水化物的酸性逐渐增强,
则酸性最强的为HClO4,
故答案为:H2SO4;H3PO4;HClO4; HClO4;
(2)A、B、C所形成气态氢化物H2O、H2S、H2Se,同主族元素从上到下元素的非金属性逐渐减弱,非金属性越强,对应的氢化物越稳定,则最稳定的是H2O,
故答案为:H2O;H2S;H2Se;H2O;
(3)D为P元素,E为Cl元素,化合物中各原子最外层都满足8电子结构,则为PCl3,电子式为

,故答案为:

;
(4)Cl2具有强氧化性,与H2S反应生成S和HCl,反应的方程式为H2S+Cl2=S+2HCl,
故答案为:H2S+Cl2=S+2HCl.
