问题
填空题
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B、D同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C3,据此填空:
(1)C的元素名称为______,其氢化物的电子式为______.
(2)C、D两种元素形成的氢化物稳定性强弱为______.(填化学式)
(3)B和D的最高价氧化物的水化物化学式分别为______和______.两者反应的离子方程式为______.
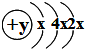
答案
由A的原子结构示意图为
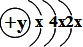
,据核外电子排布规律x仍为2,y=14,A为硅,A与B同周期,原子序数A>B,B和C可形成离子化合物B3C2,可推知B的化合价为+3,应为铝,C为氧,D和C同主族,均为短周期元素,则D为硫,由此得到B为B为Al,C为O,D为S.
(1)C为氧元素,其氢化物为H2O,电子式为
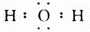
,故答案为:氧;
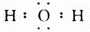
;
(2)C、D两种元素形成的氢化物分别为H2O、H2S,由于非金属性O>S,则稳定性H2O>H2S,故答案为:H2O>H2S;
(3)B为Al,对应的最高价氧化物的水化物为Al(OH)3,D为S元素,对应的最高价氧化物的水化物为H2SO4,两者反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3;H2SO4;Al(OH)3+3H+=Al3++3H2O.
