原子序数递增的部分短周期主族元素的原子半径数据如下表:
| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |
(2)B在周期表中的位置为______;AD2的电子式为______.
(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为______.
(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是______,反应的化学方程式为______.
(1)由原子半径关系可知A、B、D、E为第二周期元素,且为非金属,应分别为C、N、O、F元素,F、G、M、N、P为第三周期元素,其中A、B、D、E不与F、G、M中的任何一种元素同族,则F、G、M应分别为Na、Mg、Al元素,根据A、B、D、E、N、P的相对位置可知,N为S元素,P为Cl元素,所以,表中相对应的元素为
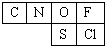
,
故答案为:

;
(2)B为N元素,原子序数为7,原子核外有2个电子层,最外层电子数为5,则位于第二周期VA族,AD2为CO2,为共价化合物,电子式为
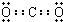
,
故答案为:第二周期VA族;
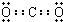
;
(3)M的最高价氧化物的水化物是Al(OH)3,胃酸的主要成分为盐酸,二者发生反应:Al(OH)3+3H+═Al3++3H2O,
故答案为:Al(OH)3+3H+═Al3++3H2O;
(4)SO2和CO2性质相似,Mg在中燃烧:2Mg+CO2
2MgO+C,则有:2Mg+SO2 点燃 .
2MgO+S,而Mg与S反应生成MgS,发生反应为:Mg+S 点燃 .
MgS,则可能的产物是MgO、MgS、S, 点燃 .
故答案为:MgO、MgS、S;2Mg+SO2
2MgO+S,Mg+S 点燃 .
MgS. 点燃 .
