(8分)现有部分短周期元素的性质或原子结构如表:
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子气态分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
①A元素在周期表中的位置______;
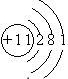
②B元素原子结构示意图______;
③C单质分子的电子式______;
(2)元素D与元素A相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去).
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为______;
②若Z是红棕色气体,则Z→W的反应的化学方程式为______.
短周期元素中:A有三个电子层,K、M层电子数之和等于L层电子数,则核外各层电子数分别为2、8、6,应为S元素,
B为短周期中金属性最强的元素,根据金属性的递变规律可知B为Na元素,
C常温下单质为双原子气态分子,氢化物的水溶液呈碱性,则C为N元素,
D元素最高正价是+7价,则应为第ⅦA族的Cl元素,则
(1)①A为S元素,原子核外有3个电子层,最外层电子数为6,应位于周期表第第三周期ⅥA族,故答案为:第三周期ⅥA族;
②B元素为Na元素,原子核外有3个电子层,最外层电子数为1,则核外电子排布示意图为

,故答案为:

;
③C为N元素,单质为N2,N原子之间有3个共用电子对,电子式为

,故答案为:

;
(2)a.常温下单质的状态属于物理性质,不能用以判断非金属性的强弱,故a错误;
b.D的氢化物比A的氢化物稳定,说明D的非金属性较强,故b正确;
c.一定条件下D和A的单质都能与钠反应,说明都具有氧化性,但不能说明非金属性的强弱,故c错误;
d.A的最高价含氧酸酸性弱于D的最高价含氧酸,说明D的非金属性较强,故d正确;
e.D单质能与A的氢化物反应生成A单质,说明D的非金属性较强,故e正确.
故答案为:bde;
(3)①Y是有刺激性气味的无色气体,则该气体为SO2,通入BaCl2溶液中,然后滴加适量H2O2溶液,发生SO2+H2O2=H2SO4,生成BaSO4白色沉淀,故答案为:BaSO4;
②若Z是红棕色气体,该气体为NO2,与水反应的方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO.
