问题
问答题
下表是元素周期表的一部分(注意:以下各空所涉及的元素填元素符号,不能用字母代替)
族 周期 | ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | 0族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A |
(2)写出C的最高价氧化物对应的水化物和E的最高价氧化物对应的水化物反应的离子方程式______.
(3)请设计实验比较B、F的金属性强弱顺序.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 金属性:B______F (填“>”、“<”或“=”) | ||
| F |
答案
(1)A位于第四周期ⅡA族,为Ca元素,D位于第二周期ⅧA族,为F元素,二者反应生成的CaF2为离子化合物,形成过程为
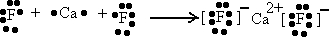
,
故答案为:
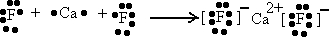
;
(2)C位于第三周期ⅢA族,为Al元素,对应的最高价氧化物的水化物为Al(OH)3,具有两性,既能与酸反应生成盐和水,又能与碱反应生成盐和水,E位于第三周期VIIA族,为Cl元素,E的最高价氧化物对应的水化物为HClO4,为强酸,二者反应的离子方程式为Al(OH)3+3H+═Al3++3H2O,故答案为:Al(OH)3+3H+═Al3++3H2O;
(3)B为第三周期ⅠA族元素,为Na元素,F为第四周期ⅠA族元素,为K元素,同主族元素从上到下,元素的金属性逐渐增强,对应的最高价氧化物的水化物的碱性逐渐增强,元素的金属性越强,其对应的单质与水反应越剧烈.故答案为:
| 元素 | 实验设计 | 现象 | 结论 |
| B | 分别在两个盛有滴加酚酞的水的烧杯中加入形状相同的Na和K. | 两个烧杯中水变为红色,加入K的烧杯反应更加剧烈. | > |
| F |

