元素周期表是学习化学的重要工具.下表为8种元素在周期表中的位置.
| A | |||||||||||||||||
| D | F | ||||||||||||||||
| G | Q | M | R | ||||||||||||||
| N | |||||||||||||||||
(2)比较M、R元素的非金属性:______>______(填元素符号).
(3)Q元素在周期表中的位置是第______周期______族,其原子结构示意图为______.
(4)Na在R的单质气体中燃烧产物的电子式为______,Na在F单质中燃烧的产物是______(填化学式).
(5)上述元素的最高价氧化物的水化物中,碱性最强的是______(填化学式),其与Q的单质反应的离子方程式是______.
(6)比较Na、G、Q 3种元素的金属性:Na>______>______(填元素符号),能证明其金属性强弱的实验依据是______.
根据元素所在周期表中的位置可知A为H元素,D为C元素,F为O元素,G为Mg元素,Q为Al元素,M为S元素,R为Cl元素,N为K元素,
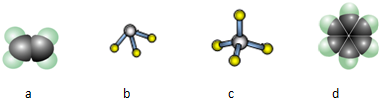
(1)A为H元素,D为C元素,二者形成的化合物为烃,题中a为C2H4,b为NH3,c为CH4,d为C6H6,
故答案为:acd;
(2)M为S元素,R为Cl元素,同周期元素从左到右元素的非金属性逐渐增强,则非金属性:Cl>S,
故答案为:Cl;S;
(3)Q为Al元素,原子核外有3个电子层,最外层电子数为3,原子结构示意图为
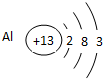
,位于周期表第三周期ⅢA族,
故答案为:三;ⅢA;
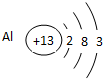
;
(4)Na在Cl2中燃烧生成NaCl,为离子化合物,电子式为
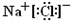
,Na在O2中燃烧生成Na2O2,
故答案为:
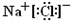
;Na2O2;
(5)金属性最强的元素为第四周期ⅠA族元素K,对应最高价氧化物的水化物KOH的碱性最强,与Al反应的离子方程式为
2Al+2OH-+2H2O=2AlO-2+3H2↑,
故答案为:KOH;2Al+2OH-+2H2O=2AlO-2+3H2↑;
(6)金属性强弱,可根据金属单质与水或酸反应的剧烈程度判断,同周期元素从左到右元素的金属性逐渐减弱,则金属性:Na>Mg>Al,
故答案为:Mg;Al;比较与水或与酸反应置换出氢气的难易程度(或比较最高价氧化物对应的水化物的碱性强弱).
