现有下列短周期元素性质的数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) | 0.74 | 1.02 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最 低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
(1)元素③在周期表中位置是______; 元素④与元素⑦相比较,气态氢化物较稳定的是______(填化学式);
(2)元素①是______(写元素符号),元素⑥是______(写元素符号),二者按照原子个数比为1:1形成的化合物与水反应的化学方程式为______;
(3)元素⑤与元素②的非金属性强弱顺序为______(写元素符号),元素⑤的单质加入到元素②的氢化物的水溶液中,反应的化学方程式为______;
(4)用电子式表示元素①氢化物的形成过程______;写出元素⑦氢化物的电子式______;写出实验室制元素⑤单质的化学反应方程式______.
+1价的③、⑥,一定是碱金属Li和Na,而原子半径⑥>③,故③应为IA族第二周期的Li,⑥为三周期的Na元素;④和⑦最高正价均为+5,负价一致,故为VA族元素,因原子半径④>⑦,故④为第三周期第VA族的P元素,⑦为N元素;从化合价可推出⑤属于卤素,由于短周期F元素无正价,故⑤为氯元素,位于第VIIA族第三周期;⑧最高正价+3价,无负价,只能是IIIA族元素,而原子半径⑧>④,故⑧只能是位于第三周期第IIIA族的Al元素;①②的最低负价为-2价,①无正价,则①应为第二周期的O元素,②最高正价+6价,为第三周期的S元素,则
(1)③为Li元素,原子序数为3,核外有2个电子层,最外层电子数为1,位于周期表第二周期ⅠA族,非金属性:N>P,则氢化物较稳定的是 NH3,
故答案为:第二周期ⅠA族;NH3;
(2)①为Na元素,⑥为O元素,二者按照原子个数比为1:1形成的化合物为Na2O2,与水反应生成NaOH和O2,反应的方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:O; Na;2Na2O2+2H2O=4NaOH+O2↑;
(3)同周期元素从左到右元素的非金属性逐渐增强,则非金属性Cl>S,Cl2通入H2S的水溶液中发生氧化还原反应生成HCl和S,反应的方程式为Cl2+H2S=2HCl+S↓,
故答案为:Cl>S;Cl2+H2S=2HCl+S↓;
(4)①的氢化物为H2O,用电子式表示的形成过程为
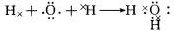
,⑦的氢化物为,属于共价化合物NH3,电子式为
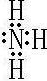
,实验室由浓盐酸和MnO2在加热条件下发生反应制备氯气,反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O, △ .
故答案为:
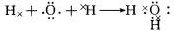
;
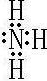
;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O. △ .
