如图是元素周期表的前三周期.请用相应的化学用语回答下列问题:
(1)写出由e形成的两种阴离子的符号,它们带有相同的电荷数:______、______;
(2)h的单质能与g元素的最高价氧化物对应水化物的溶液反应,请写出该反应的化学方程式______
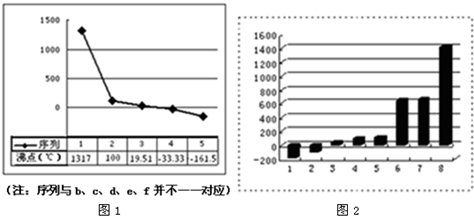
(3)图1表示的是b、c、d、e、f的氢化物的沸点(℃).序列“5”的氢化物是由______键构成的______分子(均填写“极性”或“非极性”).由c和 e 组成的可灭火的物质的电子式是______.
(4)图2是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则柱形“8”熔点最高的原因是______.
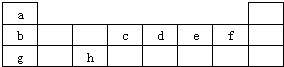
由元素在周期表中的位置可知:a为H元素、b为Li元素、c为C元素、d为N元素、e为O元素、f为F元素、g为Na元素、h为Al元素,
(1)氧元素的两种带有相同的电荷数的阴离子为O2-、O22-,故答案为:O2-;O22-;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为:2NaOH+2Al+2H2O=2NaAlO2+3H2↑,
故答案为:2NaOH+2Al+2H2O=2NaAlO2+3H2↑;
(3)序列“5”的氢化物沸点最低为CH4,C-H键为极性键,甲烷分子为正四面体构型,为对称结构,属于非极性分子,
由C和O元素组成的可灭火的物质为CO2,碳原子与氧原子之间形成2对共用电子对,电子式为

,
故答案为:极性;非极性;

;
(4)柱形“8”熔点最高,应表示晶体硅,晶体硅是原子晶体,熔点最高,故答案为:晶体硅是原子晶体,熔点最高.
