有A、B、C、D、E五种短周期元素,其中A、B、C三元素在元素周期表中的位置如图所示,已知A、C两种元素的质子数之和等于B的质子数,B、D、E属于同一周期,D元素原子的最外层只有一个电子,E元素的质子比D元素的质子数多两个.据此填空:
(1)A在元素周期表中的位置为______,A、B、C、D、E的单质中,氧化性最强的是______(写化学式).
(2)A的氢化物的结构式为______,属于______(填“共价”或“离子”)化合物.
(3)C的氢化物的电子式为______,由电子式表示D和B所形成的化合物的过程______.
(4)E的氧化物与D的最高价氧化物对应的水化物反应的离子方程式为______.
| A | C | |
| B |
设A的原子序数为x,根据A、B、C三元素在元素周期表中的位置,则C的原子序数为x+2,B的原子序数为x+9,又A、C两种元素的质子数之和等于B的质子数,则有x+x+2=x+9,x=7,所以A为N元素,B为S元素,C为F元素,B、D、E属于同一周期,D元素原子的最外层只有一个电子,则D为Na元素,E元素的质子比D元素的质子数多两个,则E为Al元素,
(1)A为N元素,原子序数为7,原子核外有2个电子层,最外层电子数为5,则位于第二周期、第VA族,根据元素非金属性的递变规律可知F元素的非金属性最强,其对应的F2单质的氧化性最强,
故答案为:第二周期、第VA族;F2;
(2)A的氢化物为NH3,为共价化合物,空间结构为三角锥形,其结构式为
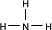
,故答案为:
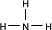
;共价;
(3)C的氢化物为HF,为共价化合物,电子式为
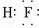
,D和B所形成的化合物为Na2S,用电子式表示形成过程为

,
故答案为:
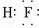
;

;
(4)E的氧化物为Al2O3,属于两性氧化物,与NaOH反应生成NaAlO2和水,反应的离子方程式为2OH-+Al2O3═2AlO2-+H2O,
故答案为:2OH-+Al2O3═2AlO2-+H2O.
