乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
②2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K=____________。
(2)条件相同时,反应①与反应②相比,转化程度更大的是________________;以CO2为原料合成乙醇的优点是________________(写出一条即可)。
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题
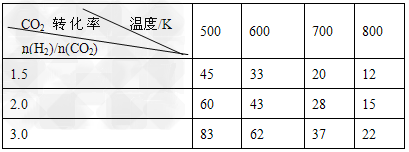
①温度升高,K值________(填“增大”、“减小”、或“不变”)。
②提高氢碳比[n(H2)/n(CO2)],K值________ (填“增大”、“减小”、或“不变”),对生成乙醇________(填“有利”或“不利”)。
(4)在下图的坐标系中作图说明压强变化对反应①的化学平衡的影响。并对图中横坐标、纵坐标的含义作必要的标注。
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料。
已知:N2(g)+2O2(g)===2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H= -534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为________________。
(1)
(2)②;废弃物利用,有利于环保(合理即可)
(3)①减小;②不变;有利
(4)
(5)2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g) △H=-1135.7kJ
