问题
填空题
下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)写出④的最高价氧化物的水化物和⑦的最高价氧化物的水化物反应的离子方程式______
(3)用电子式表示元素④与⑥的化合物的形成过程:______,该化合物属于______(填“共价”或“离子”)化合物.
答案
(1)碱性最强的元素对应的金属的金属性最强,应为④,即K元素,对应的碱为KOH,为离子化合物,
电子式为
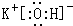
,故答案为:
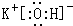
;
(2)④位于第三周期第ⅠA族,为Na元素,对应的最高价氧化物的水化物为NaOH,为强碱,
⑦位于第三周期第ⅥⅠA族,为Cl元素,对应的最高价氧化物的水化物为HClO4,为强酸,
反应的离子方程式为H++OH-=H2O,故答案为:H++OH-=H2O;
(3)⑥为与第三周期、第ⅥA族,为S元素,形成的化合物为Na2S,为离子化合物,
电子式表示元素Na与S的化合物的形成过程为:

,
故答案为:

;离子.
