如表是元素周期表的一部分,列出了十个元素在周期表中的位置:
| 族 周期 | IA | IIA | IIIA | VIA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)十个元素中化学性质最不活泼的是______;元素⑨与元素①形成的化合物以______键结合(填极性共价键、非极性共价键、离子键).
(2)元素⑧与元素⑥形成的化合物的分子式______,它们属于______化合物(填共价化、离子).
(3)⑦号元素氢化物的分子式是______,⑨号元素氢化物的电子式是______,⑦号元素氢化物和元素②反应的离子方程式:______.
(4)①、③和⑤三种元素最高价氧化物的水化物的碱性由强到弱顺序的是______>______>______.
(5)②、③和④三种元素所形成的简单离子的半径大小次序是:______<______<______.
由元素周期表可知,①为Na,②为K,③为Mg,④为Ca,⑤为Al,⑥为C,⑦为O,⑧为Cl,⑨为Br,⑩为Ar,
(1)以上元素中,只有Ar的最外层电子数为8,为稳定结构,则化学性质最不活泼,Na与Br形成离子化合物NaBr,以离子键结合,故答案为:Ar;离子;
(2)Cl与C形成的化合物为CCl4,以共价键结合,则属于共价化合物,故答案为:CCl4;共价;
(3)氧元素的氢化物为H2O,Br的氢化物为HBr,为共价化合物,其电子式为
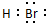
,水与钾反应生成氢氧化钾和氢气,其化学反应方程式为2K+2H2O═2KOH+H2↑,离子反应为2K+2H2O═2K++2OH-+H2↑,
故答案为:H2O;
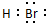
;2K+2H2O═2K++2OH-+H2↑;
(4)Na、Mg、Al在同周期,金属性为Na>Mg>Al,则种元素最高价氧化物的水化物的碱性由强到弱顺序的是
NaOH>Mg(OH)2>Al(OH)3,
故答案为:NaOH;Mg(OH)2;Al(OH)3;
(5)②为K,③为Mg,④为Ca,镁离子有2个电子层,则离子半径最小,而钾离子与钙离子具有相同的电子层结构,离子半径越小的其原子序数越大,
即离子半径的关系为Mg2+<Ca2+<K+,故答案为:Mg2+;Ca2+;K+.
