以下是元素周期表的一部分,回答下列有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
(2)在这些元素中,最不活泼的元素是______(用元素符号作答).
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是______;(用化学式作答,下同)碱性最强的是______;呈两性的氢氧化物的是______.
(4)在这些元素中,原子半径最大的是______(用元素符号作答).
(5)这些元素中形成的碱性最强的碱与呈两性的氢氧化物恰好反应的离子方程式是______.
由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,(11)为Ca,(12)为Br,
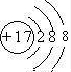
(1)⑥为硅,元素符号为Si,Cl的质子数为17,容易得到1个电子变为离子,离子结构示意图为
,F2的电子式为
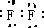
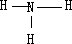
,氨气的结构式为
,
故答案为:Si;

;
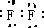
;

;
(2)上述元素中只有Ar原子的最外层电子数为8,性质不活泼,故答案为:Ar;
(3)上述元素中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,Al(OH)3为两性氢氧化物,
故答案为:HClO4;KOH;Al(OH)3;
(4)电子层越多,半径越大,同一周期,从左到右半径在减小,则K的原子半径最大,故答案为:K;
(5)KOH为碱性最强的碱,Al(OH)3为两性氢氧化物,恰好反应的离子方程式为Al(OH)3+OH -=AlO2 -+2H2O,故答案为:Al(OH)3+OH -=AlO2 -+2H2O.
