A、B、C、D是同一周期中的四种短周期元素,且A、B、C的原子序数依次相差1,A元素单质的化学性质非常活泼;B元素的单质与H2SO4完全反应,其物质的量之比为1:1;B元素的单质与D元素的单质反应生成BD2型化合物.根据以上信息,请解答下列问题.
(1)用电子式表示BD2:______.
(2)C在元素周期表中属于第______周期,______族.
(3)写出B的氧化物与H2SO4反应的化学方程式:______.
B元素的单质与H2SO4完全反应,其物质的量之比为1:1,说明B元素为最高化合价为+2价的金属元素,应为Mg,A、B、C的原子序数依次相差1,A元素单质的化学性质非常活泼,应为Na元素,则C为Al元素,B元素的单质与D元素的单质反应生成BD2型化合物,说明D的化合价为-1,且A、B、C、D是同一周期中的四种短周期元素,则D为Cl元素,
(1)B为Mg元素,D为Cl元素,所形成的化合物为MgCl2,为离子化合物,电子式为
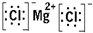
,故答案为:
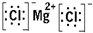
;
(2)C为Al元素,原子序数为13,核外有3个电子层,最外层电子数为3,应在周期表第三周期ⅢA族,故答案为:三;ⅢA;
(3)B的氧化物为MgO,为碱性氧化物,与硫酸反应生成盐和水,反应的化学方程式为MgO+H2SO4═MgSO4+H2O,
故答案为:MgO+H2SO4═MgSO4+H2O.
