下表为第2、3周期某些元素性质的数据.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径/10-10m | 0.73 | 1.36 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.02 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | |||
| -2 | -3 | -2 |
(1)③在周期表中的位置______.
(2)⑤元素最高价氧化物对应的水化物的名称______.
(3)由①⑤⑥三种元素组成一种化合物是家用消毒液的主要成分,其溶液显______ 性(填酸或碱),原因可用离子方程式表示:______.
(4)用化学方程式举例⑤元素的单质一种用途:______.
(5)已知⑥和①的单质在常温和加热时都能反应,分别生成化合物甲和乙,同时若1mol⑥参加反应分别放出aKJ和bKJ热量.请写出由甲转化为乙的热化学方程式:______
(6)②和⑦组成的化合物含有的化学键为______.
(7)在家用电热水器不锈钢内胆表面经常镶嵌②的单质,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:______.
①和⑧最低化合价都为-2价,应都位于ⅥA族,半径⑧>①,则①为O元素,⑧为S元素,⑦最低化合价为-3价,应为第ⅤA族元素,且原子半径和①相近,说明二者位于同一周期,则⑦为N元素,④的最高化合价为+5价,也应为第ⅤA族元素,半径④>⑦,则④为P元素,③⑥最高化合价都为+1价,为第ⅠA元素,由于半径③<⑥,则③为Li元素,⑥为Na元素,②最高化合价为+2价,应为第ⅡA族元素,由于半径③<②<⑥,则②为Mg元素,⑤最高化合价为+7价,应为第ⅦA族元素,由于半径和④相近,应为Cl元素,则
(1)③为Li元素,原子核外有2个电子层,最外层电子为1,应位于周期表第二周期、ⅠA族,故答案为:第二周期、ⅠA族;
(2)⑤为Cl元素,对应的最高价氧化物对应的水化物为高氯酸,故答案为:高氯酸;
(3)由①⑤⑥三种元素组成一种化合物为NaClO,为强碱弱酸盐,溶液中存在:ClO-+H2O
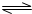
HClO+OH-,溶液呈碱性,
故答案为:碱; ClO-+H2O
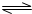
HClO+OH-;
(4)Cl2常用于制备HCl,反应方程式为Cl2+H2═2HCl,故答案为:Cl2+H2═2HCl;
(5)由题意可知:①4Na(S)+O2(g)═2Na2O(s)△H=-4aKJ•mol-1,
②2Na(S)+O2(g)═Na2O2(s)△H=-2bKJ•mol-1,
②×2-②可得:2Na2O(S)+O2(g)═2Na2O2(s)
对应的△H=-(4b-4a) KJ•mol-1,所以热化学方程式为2Na2O(S)+O2(g)═2Na2O2(s)△H=-(4b-4a) KJ•mol-1,
故答案为:2Na2O(S)+O2(g)═2Na2O2(s)△H=-(4b-4a) KJ•mol-1;
(6))②和⑦组成的化合物为Mg3N2,为离子化合物,电子式为
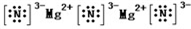
,含有离子键,
故答案为:离子键;
(7)金属发生电化学腐蚀,正极发生还原反应,电极反应式为O2+4e-+2H2O═4OH-,故答案为:O2+4e-+2H2O═4OH-.
