下列为元素周期表中的一部分,除注明外其他都用化学用语回答下列问题:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ||||
| 4 | ② | ④ |
(2)①②⑤的最高价氧化物对应水化物的碱性由强到弱的顺序为______;
(3)②③④中形成的简单离子半径由大到小的顺序为______;
(4)⑥的氢化物常温下与元素②的过氧化物反应的离子方程式为______;
(5)①和⑥形成的淡黄色固体的电子式为______,所含化学键的类型为(填“离子键”或“共价键”)______;
(6)①和⑤的最高价氧化物对应水化物相互反应的离子方程式为______.
(1)化学性质最不活泼的应为0族元素对应的单质,为Ar元素,在周期表中,同周期从左到右非金属性逐渐增强,同主族从上到下非金属性逐渐减弱,则8种元素中,
非金属性最强的是F,故答案为:Ar;F;
(2)①②⑤的最高价氧化物对应水化物分别是KOH、NaOH、Al(OH)3,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,根据金属性的递变规律可知,
金属性:K>Na>Al,则碱性KOH>NaOH>Al(OH)3,故答案为:KOH>NaOH>Al(OH)3;
(3)②③④中形成的简单离子分别为K+、Ca2+、Mg2+,由同周期金属离子半径从左到右逐渐减小,同主族离子半径从上到下逐渐增大可知,离子半径K+>Ca2+>Mg2+,
故答案为:K+>Ca2+>Mg2+;
(4)⑥的氢化物为H2O,元素②的过氧化物为Na2O2,二者发生氧化还原反应生成NaOH和O2,
反应的离子方程式为2H2O+2Na2O2=4Na++4OH-+O2↑,故答案为:2H2O+2Na2O2=4Na++4OH-+O2↑;
(5)①和⑥形成的淡黄色固体Na2O2,为离子化合物,电子式为
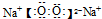
,化合物中含有离子键和共价键,
故答案为:
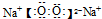
;离子键和共价键;
(6)①和⑤的最高价氧化物对应水化物分别为NaOH、Al(OH)3,Al(OH)3具有两性,能与NaOH反应生成AlO2-和水,反应的离子方程式为OH-+Al(OH)3 =AlO2-+2H2O,
故答案为:OH-+Al(OH)3 =AlO2-+2H2O.
