A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素的名称分别为______、______、______;
(2)B位于元素周期表中第______周期,第______族;
(3)C的原子结构示意图为______,C的单质与水反应的化学方程式为______;
(4)比较B、C的原子半径;B______C,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式______.
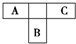
(1)依题意,A、B、C为短周期元素,从A、B、C的相对位置看,A、C只能处在第二周期,而B处在第三周期.设A的原子序数为x-1,则C为x+1,B为x+8,则有:(x-1)+x+1=x+8 x=8.所以A、B、C的原子序数分别为7、16、9,对应的元素分别为N、S、F.
故答案为:氮 硫 氟
(2)S位于第三周期ⅥA主族,故答案为:三ⅥA
(3)F原子核外有2个电子层,最外层7个电子,原子结构示意图为

,F2与H2O反应生成氟化氢和氧气,
故答案为:

;2F2+2H2O═4HF+O2
(4)S的原子半径比同主族的O要大,而O比同周期的F要大,因此,S的原子半径大于F的原子半径.A的气态氢化物NH3与B的最高价氧化物对应水化物H2SO4反应生成(NH4)2SO4
故答案为:>2NH3+H2SO4═(NH4)2SO4
