A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M.1molM中含有42mol电子.回答下列问题:
(1)E元素在周期表中的位置______;化合物M中含有的化学 键类型有______.
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是(用化学 式表示):______;写出C与A形成的18e-化合物的电子式______;
(3)用电子式表示A2C的形成过程:______
(4)写出C与E两元素形成的化合物与Y溶液反应的离子方程式:______;写出题中生成M的化学方程式______
(5)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则负极上的电极反应式为______,若标准状况下,正极消耗3.36L气体,则通过外电路的电子是______个.
E的单质可做半导体材料,应为Si元素,B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,则B应为非金属元素,只有N元素符合,形成的化合物为NH4NO3,1mol中含有42mol电子,B、D、E三种元素原子的最外层电子数之和为10,则D的最外层电子数为10-4-5=1,又D的原子序数最大,应为Na元素,A、D同主族,且A的原子序数和原子半径都最小,应为H元素,根据C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应,应是SiO2和NaOH的反应,则C为O元素,
(1)由以上分析可知E为Si元素,原子序数为14,原子核外有3个电子层,最外层电子数为4,则应位于周期表第三周期、第ⅣA族,M为NH4NO3,为离子化合物,含有离子键和极性共价键,故答案为:第三周期、第ⅣA族;离子键和极性共价键;
(2)B、C、E形成的气态氢化物分别为NH3、H2O、SiH4,由于非金属性O>N>Si,则氢化物稳定性为H2O>NH3>SiH4,
C与A形成的化合物中,H2O2含有18个e-,其电子式为
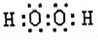
,
故答案为:H2O>NH3>SiH4;
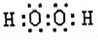
;
(3)A2C为H2O,为共价化合物,可用电子式表示其形成过程为
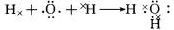
,
故答案为:
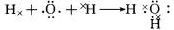
;
(4)SiO2为酸性氧化物,与NaOH反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,题中生成M的化学方程式为NH3+HNO3=NH4NO3,
故答案为:SiO2+2OH-=SiO32-+H2O;NH3+HNO3=NH4NO3;
(5)碱性氢氧电池中,负极通入氢气,发生氧化反应,电极反应式为H2+2OH--2e-=2H2O,正极为氧气参加反应,
n(O2)=
=0.15mol,则通过外电路的电子n(e-)=4n(O2)=0.6mol,N(e-)=0.6 NA(或3.612×1023),3.36L 22.4L/mol
故答案为:H2+2OH--2e-=2H2O;0.6 NA(或3.612×1023).
