A、B、C、D、E都是短周期元素,原子序数依次增大;A原子中电子运动的轨道只有一种形状;B、C同周期,A、D同主族.D、B能形成两种离子化合物甲和乙,原子个数比分别为2:1和1:1;E元素原子的最外层电子数是其电子总数的
.根据以上信息回答下列问题:1 3
(1)甲、乙中含有非极性键的物质的电子式是______.
(2)E、C分别形成的氢化物稳定性大小关系是______.(用氢化物的化学式作答)
(3)C和D的离子中,半径较小的是______(填离子符号).画出C和D的离子的结构示意图______,______.
(4)写出B元素基态原子的轨道表示式______.
(5)X是与E同主族的短周期元素,下表列出了X原子间各种共价键的键能:
| 键类型 | X-X | X=X | X≡X |
| 键能(kJ/mol) | 159 | 418 | 946 |
A、B、C、D、E都是短周期主族元素,原子序数依次增大,A原子中电子运动的轨道只有一种形状,核外只有1个电子,故A为H元素,A、D同主族,与A的原子序数之差大于2,故D为Na元素,D、B能形成两种离子化合物甲和乙,原子个数比分别为2:1和1:1,故B为氧元素,甲为Na2O,乙为Na2O2,B、C同周期,故C为F元素,E元素原子的最外层电子数是其电子总数的
,E处于第三周期,令最外层电子数为x,则10+x=3x,解得x=5,故E为P元素,则1 3
(1)甲为Na2O,乙为Na2O2,含有非极性键的物质是Na2O2,Na2O2的电子式是
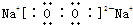
,
故答案为:
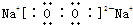
;
(2)非金属性F>P,非金属性越强,氢化物越稳定,故氢化物稳定性为HF>PH3,
故答案为:HF>PH3;
(3)F-与Na+具有相同的电子层结构,核电荷数越大,离子半径越小,故半径较小的是Na+,F-的离子的结构示意图为
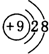
,Na+的离子的结构示意图为
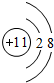
,
故答案为:Na+,

,
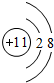
;
(4)B为氧元素,O元素基态原子的轨道表示式
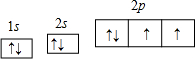
,
故答案为:

;
(5)X是与E同主族的短周期元素,故X为N元素,N-N单键为σ键,键能为159kJ/mol,N=N双键中有1个σ键,1个π键,故N=N双键中π键d键能为418kJ/mol-159kJ/mol=259kJ/mol,N≡N中有1个σ键,2个π键,故N≡N三键中π键的键能为
(946kJ/mol-159kJ/mol)=393.5kJ/mol,键能越大化学键越稳定,故N2中π键比σ键稳定,1 2
故答案为:π键比σ键稳定.
