实验室里现有一包氯化镁和氯化钠的固体混合物样品,某同学取该样品12.8 g,使之完全溶解在50 g水中,再向其中加入40 g20%的氢氧化钠溶液,恰好完全反应.求:(计算结果用百分数表示,保留到小数点后一位数字)
(1)样品中氯化镁的质量.
(2)反应后所得溶液中氯化钠的质量分数.
氢氧化钠只与混合物中氯化镁反应,产生氢氧化镁沉淀;根据氢氧化钠的质量计算出氯化镁的质量,以及产生的氯化钠的质量,计算氯化钠的质量分数时需沣意加上原混合物中氯化钠的质量.
(1)设样品中氯化镁的质量为x.
MgCl2+2NaOH===Mg(OH)2↓+2NaCl
95 80 58 117
x 40 g×20% y z
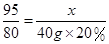 解得x=9.5 g
解得x=9.5 g
(2)设反应后生成Mg(OH)2的质量为y,生成NaCl的质量为z.
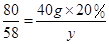 解得y=5.8 g
解得y=5.8 g
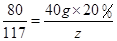 解得z=11.7 g
解得z=11.7 g
反应后所得溶液中氯化钠的质量分数: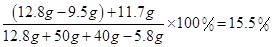
答:略.
分析:固体混合物中的氯化钠不能与氢氧化钠反应,而氯化镁与氢氧化钠反应生成氢氧化镁和氯化钠,恰好完全反应后所得溶液为氯化钠溶液;根据反应的化学方程式,由参加反应的氢氧化钠的质量可计算参加反应的氯化镁的质量和生成的氯化钠的质量;
反应后所得氯化钠溶液中溶质氯化钠由两部分构成,一是原样品中的氯化钠,可利用样品质量与氯化镁的质量差计算出来;一是反应生成的氯化钠;由两部分氯化钠的质量和与反应后溶液的质量比,计算出反应后所得溶液中氯化钠的质量分数.
解答:(1)设样品中氯化镁的质量为x.
MgCl2+2NaOH===Mg(OH)2↓+2NaCl
95 80 58 117
x 40 g×20% y z
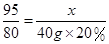 解得x=9.5 g
解得x=9.5 g
(2)设反应后生成Mg(OH)2的质量为y,生成NaCl的质量为z.
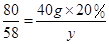 解得y=5.8 g
解得y=5.8 g
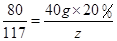 解得z=11.7 g
解得z=11.7 g
反应后所得溶液中氯化钠的质量分数: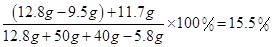
答:(1)样品中氯化镁的质量为9.5g;(2)反应后所得溶液中氯化钠的质量分数为15.5%.
点评:氢氧化钠只与混合物中氯化镁反应,产生氢氧化镁沉淀;根据氢氧化钠的质量计算出氯化镁的质量,以及产生的氯化钠的质量,计算氯化钠的质量分数时需注意加上原混合物中氯化钠的质量.
