问题
问答题
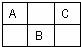
如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)
(1)A______B______C______.
(2)B的最高价氧化物的化学式______,属于______晶体.
(3)C的气态氢化物的化学式______,其中存在______键.
答案
设B的原子序数为x,根据三种元素所在元素周期表中的位置可知,A的原子序数为x-9,C的原子序数为x-7,
原子核外电子数=质子数=原子序数,则有x-7+x-9+x=2x,x=16,所以B为S元素,A为N元素,C为F元素,
(1)由以上分析可知,B为S元素,A为N元素,C为F元素,故答案为:N;S;F;
(2)B为S元素,S元素最外层电子数为6,则最高正化合价为+6价,则最高价氧化物的化学式为SO3,属于分子晶体,
故答案为:SO3;分子;
(3)C为F元素,C的气态氢化物的化学式为HF,由非金属元素形式的化合物,原子间的作用力为共价键,
故答案为:HF;共价.

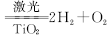 ,下列说法中不正确的是
,下列说法中不正确的是