问题
选择题
已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是( )
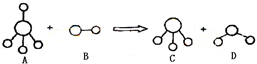
A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
答案
结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D,A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10,A为5原子离子,则A为NH4+,B为2原子离子,故B为OH-,则C为NH3,D为H2O,
A.NH3与H2O反应生成NH3•H2O,故A错误;
B.A为NH4+离子,不是分子,故B错误;
C.D为H2O,由于水分子之间存在氢键,沸点高于H2S,故C错误;
D.氯化铵为强酸弱碱盐,NH4+离子水解,溶液呈酸性,故D正确;
故选D.
