原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是______(填名称),W在周期表中的位置______.
(2)X与Y 形成化合物的电子式为______,X与W组成的化合物中存在______键(填“离子”“共价”).
(3)写出实验室制备YX3的化学方程式:______
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.则A的名称是______.
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水.对化合物B进行如下实验:
a. 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;b. 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解则B的化学式为______.
根据原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N,Z为O,W为S,
(1)X为H,其名称为氢,W为S,位于元素周期表中第三周期第ⅥA族,故答案为:氢;第三周期第ⅥA族;
(2)H原子最外层有1个电子,N原子最外层有5个电子,则氨气的电子式为
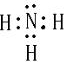
,H、S之间以共用电子对形成化合物,则以共价键结合,
故答案为:
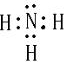
;共价;
(3)①实验室制取氨气利用氯化铵与碱石灰共热来反应得到,该反应为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O, △ .
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O; △ .
(4)X、Y、Z、W四种元素组成的一种离子化合物中的阳离子为NH4+,阴离子为硫酸根离子或硫酸氢根离子,但1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体,
则1molA中含有2molNH4+,则A为硫酸铵,故答案为:硫酸铵;
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,由B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色可知B中含有Fe2+、NH4+,另取B的溶液,加入过量
BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则B中含有硫酸根离子,又1mol B中含有6mol结晶水,由相对分子质量为
392及化合物中正负化合价的代数和为零可知,B为(NH4)2Fe (SO4)2•6H2O,故答案为:(NH4)2Fe (SO4)2•6H2O.
