A、B、C、D、E为原子序数依次增大的短周期元素,其中A原子中无中子,A与D同主族.B元素的氢化物水溶液能使红色石蕊试纸变蓝,C与E同主族,D与E同周期,E原子的最外层电子数等于两个内层电子数之差.回答下列问题:
(1)写出D元素的名称:______;比较原子半径B______C(填“>”或“<”);
(2)由A、C、D元素形成的化合物中含有的化学键是______;
(3)化合物A2C的电子式为______;
(4)物质M由B元素的氢化物和最高价氧化物的水化物反应得到,则M属于______晶体(填原子、分子或离子);
(5)由A、C形成的化合物和C、E形成的化合物发生反应只生成强酸,其化学方程式为______.
A、B、C、D、E为原子序数依次增大的短周期元素,其中A原子中无中子,则A为氢元素;A与D同主族,D的原子序数与氢元素原子序数之差大于2,故D为Na元素;B元素的氢化物水溶液能使红色石蕊试纸变蓝,溶液呈碱性,故B为氮元素;D与E同周期,常用第三周期,E原子的最外层电子数等于两个内层电子数之差,则E原子最外层电子数为8-2=6,故E为硫元素,C与E同主族,故C为氧元素,
(1)由上述分析可知,D为钠元素;同周期自左而右原子半径减小,故原子半径N>O,
故答案为:钠;>;
(2)H、O、Na三种元素组成的化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,故NaOH中存在离子键、共价键,
故答案为:离子键、共价键;
(3)H2O分子中氧原子与氢原子之间形成1对共用电子对,氧原子有2对孤电子对,电子式为
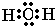
,
故答案为:
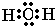
;
(4)物质M由N元素的氢化物和最高价氧化物的水化物反应得到,则M为硝酸铵,属于离子晶体,
故答案为:离子;
(5)由H、O形成的化合物和O、S形成的化合物发生反应只生成强酸,故生成硫酸,应为三氧化硫与水反应,或过氧化氢与二氧化硫反应,化学方程式为:H2O+SO3=H2SO4或H2O2+SO2=H2SO4,
故答案为:H2O+SO3=H2SO4或H2O2+SO2=H2SO4.
