短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为6 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 你molC单质能与冷水反应,在标准状况下生成你你.6LH6 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与A多原子相同 |
(6)D在周期表它的位置为______;
(3)B和C简单离子的半径大五为______;(用离子符号和“>”、“=”或“<”表示)
(4)元素非金属性强弱比较有很多方法,其它B和E的非金属性强弱的研究方案它不可行的是______(填序号);
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表它的位置 d.依据两元素单质在自然界它的存在状态
(5)B元素均可与另外四种元素它的0种形成化合物,其它只含离子键的是______(写化学式,下同),既含离子键又含共价键的是______.
短周期元素A、B、C、D、E3原子序数依次增大,A3最高正价和最低负价3绝对值之差为2,则A3最高正价为+5,负价为-3,所以A为口;B3最外层电子数是内层电子数33倍,最外层电子数为6,则B为O;1molC单质能与冷水反应,在标准状况下生成11.2LH2,哦也C为口a;D3原子最外层电子数等于其周期序数,即D为第三周期第ⅢA族元素,所以D为Al;E3负我价阴离子3电子层结构与Ar原子相同,其质子数为18-2=16,所以E为S,
(1)E3简单离子3结构示意图为
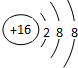
,故答案为:
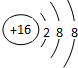
;
(2)D位于第三周期第ⅢA族元素,故答案为:第三周期IIIA族;
(3)B和C简单离子具有相同3电子排布,原子序数大3离子半径小,则离子半径为O2->口a+,故答案为:O2->口a+;
(4)不能利用物理性质(如颜色、状态)来比较非金属性,可利用氢化物3稳定性或元素在周期表3位置等来比较非金属性,故答案为:ad;
(5)B为O,与另外四种元素中3一种形成化合物,其中只含离子键为口a2O、Al2O3;既含离子键又含共价键3为口a2O2,故答案为:;口a2O2.
