现有Na2CO3和Na2SO4的固体混合物共18 g,将它放入98 g20%的H2SO4溶液中,充分反应后溶液呈酸性;向此酸性溶液中再逐滴加入84 g10%的Na2CO3溶液,恰好完全反应。计算所得溶液中溶质的质量分数。(计算结果精确到0.1%)
17.6%
题目分析:解:设参加反应的Na2CO3的质量为x,生成Na2SO4的质量为y,生成CO2的质量为z。
Na2CO3 + H2SO4 = Na2SO4 + H2O+ CO2↑
106 98 142 44
x 98 g×20% y z
106:98=x:98 g×20%
x ="21.2" g
98:142=" 98" g×20%:y
y="28.4" g
98:44=" 98" g×20%:z
z="8.8" g
原固体混合物中Na2CO3质量为:21.2 g-84 g×10%="12.8" g
Na2SO4总质量为:28.4 g+(18 g-12.8 g)="33.6" g
反应后所得溶液中硫酸钠的质量分数为:
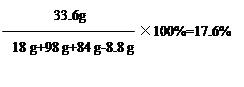
答:反应后所得溶液中硫酸钠的质量分数为17.6%
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
溶质质量分数= 。
。
