有A、B、C、D、E、F六种前四周期元素,原子序数A<B<C<D<E<F.A原子只有一个电子层且只含1个电子;B、C两元素的基态原子具有相同能级,且I1(B)>I1(C),其中基态B原子的2p轨道上有3个未成对电子;D原子s电子数比p电子数少4;E原子的3p轨道上得到1个电子后不能再容纳外来电子;F为周期表前四周期中电负性最小的元素.
(1)写出下列元素的元素符号:C______F______
(2)写出E元素原子的价电子轨道表示式______.
(3)B、C两元素原子的电负性大小:B______C(填“<”或“>”).
(4)A2C与A2D的熔沸点:A2C______A2D(填“<”或“>”).
(5)A、C两元素按原子个数比为1:1结合成的化合物化学式为______.
(6)BA3的中心原子杂化方式为______杂化,该化合物的空间构型为______.
A、B、C、D、E、F六种前四周期元素,原子序数A<B<C<D<E<F.A原子只有一个电子层且只含1个电子,则A为氢元素;B、C两元素的基态原子具有相同能级,二者处于处于同周期,基态B原子的2p轨道上有3个未成对电子,则B为氮元素,且I1(B)>I1(C),C的原子序数大于B,则C为氧元素;E原子的3p轨道上得到1个电子后不能再容纳外来电子,则3p容纳7个电子,故E为Cl元素;F为周期表前四周期中电负性最小的元素,则F为K元素;D原子s电子数比p电子数少4,D不可能处于第二周期,因为p电子最多为6,不符合题意,由原子序数关系可知D处于第三周期,核外电子排布为1s22s22p63s23p4,为S元素,
(1)由上述分析可知,C为O元素,F为K元素,故答案为:O;K;
(2)E为Cl元素,原子的价电子轨道表示式为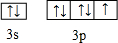 ,故答案为:
,故答案为: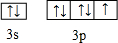 ;
;
(3)同周期自左而右电负性增大,故电负性大小:N<O,故答案为:<;
(4)H2O分子之间存在氢键,常温下为液态,H2S常温下为气态,故熔沸点:H2O>H2S,故答案为:>;
(5)H、O两元素按原子个数比为1:1结合成的化合物化学式为H2O2,故答案为:H2O2;
(6)NH3的中心N原子价层电子对数为3+1=4,含有1对孤电子对,采取sp3杂化方式,空间构型为三角锥型,故答案为:sp3;三角锥型.
