A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2.C、D的电离能数据如下(kJ•mol-1):
| I1 | I2 | I3 | I4 | |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含______个σ键,______个π键;
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应.根据下表数据,说明AB比甲活泼的原因是______.
| 单键 | 双键 | 叁键 | ||
| AB | 键能(kJ•mol-1) | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能(kJ•mol-1) | 154.8 | 418.4 | 941.7 |
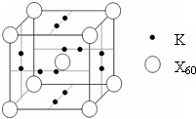 (4)E能与AB形成配合物,其中E提供______,AB提供______.
(4)E能与AB形成配合物,其中E提供______,AB提供______.(5)如图所示晶胞中,阳离子与阴离子的个数为______.
A、B、C、D四种短周期元素原子序数依次增大,B元素的最外层电子数是其电子层数的3倍,由于最外层电子数不超过8,1个电子层最多容纳2个电子,故B原子有2个电子层,最外层电子数为6,则B为氧元素;A元素原子的价电子排列为ns2np2,处于ⅣA族,原子序数小于氧元素,则A为碳元素;C元素的第三电离能剧增,表现+2价,处于ⅡA,原子序数大于氧元素,故C为Mg元素;D元素的第四电离能剧增,表现+3价,处于ⅢA族,则D为Al元素;E元素原子的价电子排布为3d64s2,核外电子数为26,为Fe元素,
(1)C元素的第三电离能剧增,表现+2价;D元素的第四电离能剧增,表现+3价,故答案为:+2;+3;
(2)某单质甲分子与化合物CO分子中电子总数相等,则甲分子为N2,分子中存在N≡N三键,包含1个σ键,2个π键,故答案为:1;2;
(3)据表中数据可知,断裂C≡O中的一个π键消耗的能量是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,断裂N≡N中的一个π键消耗的能量是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼,
故答案为:断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼;
(4)E为Fe,含有空轨道,CO含有孤对电子,二者形成配合物,故答案为:空轨道;孤对电子;
(5)由晶胞结构可知,晶胞中含有K+离子数目为2×6×
=6,阴离子数目为1+8×1 2
=2,故阳离子与阴离子的个数为6:2=3:1,故答案为:3:1.1 8
