元素A~G是元素周期表中的7种短周期元素,请根据表中信息回答下列问题:
| 元素 | A | B | C | D | E | F | G |
| 性 质 结 构 信 息 | 制成的高压灯,发出的黄光透雾能力强、射程远. | 工业上通过分离液态空气获得其单质.原子的最外层未达稳定结构. | 常温常压下是气体,元素的常见化合价为-1及多种正价. | +2价阳离子核外电子数与氖原子相同. | E和F是同主族元素,都有同素异形体.E的一种分子与F原子电子数目相同. | 常温下,其单质能与烧碱溶液反应放出气体,其氧化物能与强酸或强碱溶液反应. | |
(2)写出D离子的结构示意图______.
(3)写出C单质与水反应的化学方程式______.
(4)写出G与烧碱溶液反应的离子方程式______.
(5)写出F元素常见的两种同素异形体的名称______.
(6)对元素B的单质或化合物描述正确的是(填序号)______.
①B元素的最高正价为+6 ②常温常压下,其单质很难与其他物质反应
③单质分子中含有18个电子 ④其氢化物极易溶于水
(7)C、E和F 三种元素的氢化物中,沸点最高的氢化物的化学式是______;C和F 两元素的氢化物中,还原性较强的是(填名称)______.
(8)A和D 两元素金属性较强的是(填元素符号)______.写出能证明该结论的一个实验事实______.
元素A~G是元素周期表中的7种短周期元素,A制成的高压灯,发出的黄光透雾能力强、射程远,则A为Na;C单质常温常压下是气体,元素的常见化合价为-1及多种正价,则C为Cl元素;D元素+2价阳离子核外电子数与氖原子相同,则D为Mg元素;E和F是同主族元素,都有同素异形体.E的一种分子与F原子电子数目相同,则E为氧元素、F为硫元素;常温下,G的单质能与烧碱溶液反应放出气体,其氧化物能与强酸或强碱溶液反应,则G为Al元素;工业上通过分离液态空气获得B的单质.原子的最外层未达稳定结构,则B为氮元素,
(1)由上述分析可知,上表中与B元素同周期的元素符号是N,
故答案为:N;
(2)D为镁元素,镁离子的结构示意图为:
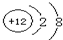
,
故答案为:
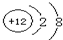
;
(3)C为Cl元素,氯气与水反应的化学方程式为:Cl2+H2O=HClO+HCl,
故答案为:Cl2+H2O=HClO+HCl;
(4)G为Al元素,AlG与烧碱溶液反应的离子方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,
故答案为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
(5)F为硫元素,常见的两种同素异形体的名称为:斜方硫、单斜硫,
故答案为:斜方硫、单斜硫;
(6)B为氮元素
①N元素的最高正价为+6,故①错误;
②常温常压下,氮气分子含有N≡N三键,化学性质物质,很难与其他物质反应,故②正确;
③氮气分子中含有14个电子,故③错误;
④氨气极易溶于水,故④正确;
故答案为:②④;
(7)C、E和F 三种元素的氢化物分别为HCl、H2O、H2S,常温下H2O为液态,HCl、H2S为气体,H2O的沸点最高;
非金属性Cl>S,故HCl、H2S中,还原性较强的是硫化氢,
故答案为:H2O;硫化氢;
(8)同周期自左而右金属性减弱,故金属性Na>Mg,Na与水反应比Mg与水反应剧烈或氢氧化钠的碱性比氢氧化镁强,可以证明Na的金属性强,
故答案为:Na;Na与水反应比Mg与水反应剧烈或氢氧化钠的碱性比氢氧化镁强.
