X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:
(1)U单质的原子堆积方式为______,Y的简单氢化物分子式为______.
(2)X的一种氢化物的相对分子质量为28,其分子中σ键与π键的键数之比为______.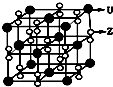
(3)化合物甲由Z、U两元素组成,其晶胞如右图所示.
①甲的化学式为______.
②下列有关该晶体的说法中正确的是______(选填选项字母).
A.每个晶胞中含有14个U+和13个Z2-
B.晶体中每个U+周围距离U+最近的Z2-有6个
C.该晶体属于离子晶体
③甲的密度为ag•cm-3,则晶胞的体积是______cm3(只要求列出计算式,阿伏加德罗常数用NA表示).
X、Y、Z、U为原子序数依次增大的前四周期元素,基态Y原子的2p轨道处于半充满状态,则外围排布为2s22p3,则Y为氮元素;X、Y、Z三种元素位于同一周期,且XZ2与Y2Z互为等电子体,X与Z的质子数之和为14,则为CO2与N2O,故X为碳元素、Z为氧元素;含U的化合物的焰色为紫色,则U为钾元素,
(1)U为钾元素,K单质的原子堆积方式为体心立方堆积;
Y的简单氢化物分子式为,
故答案为:体心立方堆积;NH3;
(2)X为碳元素,一种氢化物的相对分子质量为28,该氢化物为C2H4,分子中含有1个C=C双键、4个C-H,C=C双键含有1个σ键、1个π键,单键为σ键,故C2H4分子中σ键与π键的键数之比为5:1
故答案为:5:1;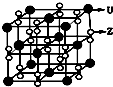
(3)化合物甲由Z、U两元素组成,其晶胞如右图所示.
①由晶胞结构可知,晶胞中K原子数目为8×
+6×1 8
=4,O原子数目为4×2×1 2
+8×1 4
+8×1 2
=8,故K原子与O原子数目之比为4:8=1:2,故甲的化学式为KO2,1 4
故答案为:KO2;
②A.由①中计算靠自己,每个晶胞中含有4个K+和4O2-,故A错误;
B.由晶胞结构可知,晶体中每个K+周围距离K+最近的O2-有6个,故B正确;
C.该晶体由K+和4O2-构成,属于离子晶体,故C正确;
故答案为:BC;
③晶胞的质量为
g,甲的密度为ag•cm-3,则晶胞的体积是4×71 NA
=
g4×71 NA ag/cm3
cm3,284 aNA
故答案为:
.284 aNA
