(16分)D、E、X、Y、Z是短周期元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)D和X形成的化合物中的化学键类型是_______________;D和Y形成的分子是_________(填“极性”或“非极性”)分子。
(2)Y和Z的简单离子的半径大小为__________(用离子符号和“>”、“=”或“<”表示)。
(3)比较元素非金属性的强弱有很多方法,关于D和X的非金属性强弱的研究方案中不可行的是_________(填序号)。
①比较氢化物的稳定性 ②依据两元素在周期表的位置 ③比较两种单质的颜色
④比较单质与H2化合的难易程度 ⑤比较最高价氧化物对应水化物的酸性
(4)当满足一定比例时,Z的单质可与E的最简单氢化物反应生成一种盐和另一种单质,试写出该反应的化学方程式________________________。
(5)写出下列反应的化学方程式:
①工业上用D的单质制X的单质___________________________________;
②E的最高价含氧酸的浓溶液与单质D反应__________________________。
(6)E有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则生成的E的含氧酸盐的化学式是__________。
(1)(极性)共价键 (2分) 非极性 (2分)
(2)r(S2-)>r(Cl-) (2分)
(3)③ (2分)
(4)3Cl2+8NH3=== N2+6 NH4Cl (2分)
(5)①2C+SiO2===Si+2CO↑ (2分)
②C+4HNO3(浓)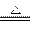 CO2↑+ 4NO2↑+2H2O (2分)
CO2↑+ 4NO2↑+2H2O (2分)
(6)NaNO2 (2分)