问题
问答题
A、B、C、D、E、F六种短周期元素的原子序数依次增大.已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个.试回答:
(1)写出下列元素A的符号______,D的名称______,C的原子结构示意图______;
(2)用电子式表示B、F形成的化合物的过程:______;
(3)写出A、C两种元素最高价氧化物的水化物之间反应的离子方程式:______.
答案
A、B、C、D、E、F六种短周期元素的原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,E原子有3个电子层,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则E的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg,
(1)由上述分析可知,A为Na,D为硅,C为Al,其原子结构示意图为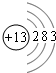 ,
,
故答案为:Na;硅; ;
;
(2)B、F形成的化合物为氯化镁,用电子式表示其形成过程为 ,
,
故答案为: ;
;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
