A、B、C、D、E五种短周期元素的原子序数依次增大,质子数之和为40,A、D同主族,B、C同周期,A、B组成的化合物为气体,该气体溶于水显碱性,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素.试回答:
(1)写出下列元素符号:A______,B______,D______.
(2)化合物A2C的电子式是______;请用电子式表示化合物D2C的形成过程______.
(3)E单质与Fe和稀硫酸构成的原电池中,Fe是______极,另外一个电极上的电极反应为______.
(4)将D单质投入A2C中的离子方程式为______.
A、B、C、D、E五种短周期元素的原子序数依次增大,质子数之和为40,A、D同主族,B、C同周期,A、B组成的化合物为气体,该气体溶于水显碱性,则该化合物是NH3,A的原子序数小于B,则A是H元素、B是N元素;
A和D同一主族,则D的原子序数大于B,所以D是Na元素;
A、C能形成两种液态化合物A2C和A2C2,C的原子序数大于B而小于D,则C是O元素;
E是地壳中含量最多的金属元素,则E是Al元素;
(1)通过以上分析知,A是H元素、B是N元素、D是Na元素,故答案为:H;N;Na;
(2)化合物H2O的电子式是 ;D2C是Na2O,电子式表示化合物Na2O的形成过程
;D2C是Na2O,电子式表示化合物Na2O的形成过程 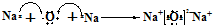 ,故答案为:
,故答案为: ;
;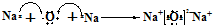 ;
;
(3)Al单质与Fe和稀硫酸构成的原电池中,Al易失电子作负极、Fe作正极,负极上电极反应式为,故答案为:Al-3e-=Al3+,故答案为:正;Al-3e-=Al3+;
(4)D是Na,A2C是水,二者反应生成氢氧化钠和氢气,所以离子方程式为2Na+2H2O═2Na++2OH-+H2↑,
故答案为:2Na+2H2O═2Na++2OH-+H2↑.
