A、B、C、D、E、F是原子序数依次增大的六种短周期元素.F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E的原子序数为B的两倍;A元素的一种核素中不含中子.请回答下列问题:
(1)C的单质分子的结构式为______;ED的电子式为______.
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为______.
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为______,由此可知CD和FD2中还原性较强的是______(填化学式).
(4)A、C、D、F四种元素按原子个数比为5:1:4:1形成化合物甲,则甲的化学式为______.将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp=x,则混合溶液中酸根离子的浓度为______mol/L(用含x的代数式表示,混合后溶液体积变化忽略不计).
A、B、C、D、E、F是原子序数依次增大的六种短周期元素.F的单质在D2中燃烧的产物可使品红溶液褪色,则F为S元素,D为O元素;B的单质在D2中燃烧可生成BD和BD2两种气体,则B为C元素;C的原子序数介于碳、氧之间,则C为N元素;E的原子序数为B的两倍,则E为Mg;A元素的一种核素中不含中子,则A为H元素,
(1)C的单质为N2,分子N原子之间形成3对共用电子对,其结构式为N≡N;ED为MgO,由镁离子与氧离子构成,电子式为 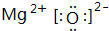 ,
,
故答案为:N≡N;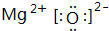 ;
;
(2)Mg在二氧化碳中燃烧生成碳与MgO,该反应的化学方程式为:2Mg+CO2
2MgO+C,点燃 .
故答案为:2Mg+CO2
2MgO+C;点燃 .
(3)SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀硫酸钡和无色气体NO,有关反应的离子方程式为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+,由此可知,还原性NO<SO2,
故答案为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+;SO2;
(4)H、N、O、S四种元素按原子个数比为5:1:4:1形成化合物甲,则甲的化学式为NH4HSO4,将0.01mol/L的NH4HSO4溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,氢氧化钡过量,反应后溶液中钡离子浓度约是:
=0.01mol/L,硫酸钡的Ksp=x,根据溶度积表达式可知,溶液中硫酸根离子的浓度为:0.03mol/L-0.01mol/L 2
mol/L=100xmol/L,x 0.01
故答案为:NH4HSO4;100x.
