(9分)长期以来一直认为氟的含氧酸不存在。但是至1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。
⑴以下两种结构式,能正确表示次氟酸结构的是 。A、H—O—F B、H—F—O
⑵次氟酸中氧元素的化合价为 ,次氟酸的电子式为 ,次氟酸分子中共价键的键角 180°(填“<”或“=”)。
⑶下面给出了几个分子和基团化学键的键能:
| H2 | O2 | F2 | OH | OF | HF | |
| E/(kJ/mol) | 432 | 494 | 155 | 424 | 220 | 566 |
请计算反应 2HOF(g) = 2HF(g) + O2(g)的反应热(△H),近似为 kJ/mol。从计算结果预测次氟酸的一条化学性质: 。
⑷次氟酸能被热水瞬间分解,生成一种常见的物质M,M是18e-,且被称为“绿色氧化剂”。写出次氟酸与热水反应的化学方程式: 。
(9分,除最后一空及反应热2分,其余每空1分)
⑴A; ⑵0、HOF的电子式(略)、<;
⑶-338、具有强氧化性; ⑷HOF+H2O HF+H2O2
HF+H2O2
(1)氧元素能写出2对电子对,所以答案选A。
(2)由于氟元素是-1价,氢元素是+1价,所以氧元素是0价。次氟酸的电子式为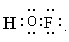 ,由于分子不是直线型结构,所以键角小于180°.
,由于分子不是直线型结构,所以键角小于180°.
(3)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此反应热为2×424kJ/mol+2×220kJ/mol-2×566kJ/mol-494kJ/mol=-338kJ/mol,即反应是放热反应,所以具有强氧化性。
(4)根据M的性质和结构可知,M应该是双氧水,方程式为HOF+H2O HF+H2O2。
HF+H2O2。

