已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原予核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题: (答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是 ,A、B、C、D的第一电离能由小到大的顺序为 。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是 ;
(3)A的最高价含氧酸根离子中,其中心原子采取 杂化,D的低价氧化物分子的空间构型是 。
(4)A、E形成某种化合物的晶胞结构如下图所示,则其化学式为 ;(每个球均表示1个原子)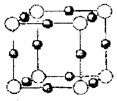
(1)1s22s22p63s23p63d104s1(或[Ar] 3d104 s1) A1<Mg<S<N
(2)MgCl2为离子晶体而A1C13为分子晶体 (3)sp2,V形 (4)Cu3N
根据元素的结构及有关性质可知,A、B、C、D、E分别是N、Mg、Al、S、Cu。
(1)根据构造原理可知,铜原子的核外电子排布式是1s22s22p63s23p63d104s1(或[Ar] 3d104 s1) ;非金属性越强,第一电离能越大,所以四种元素的第一电离能大小顺序是A1<Mg<S<N。
(2)由于MgCl2为离子晶体,而A1C13为分子晶体,所以前者的熔点远高于后者。
(3)NO3-中氮原子能源孤对电子,所以其结构是平面三角形结构,氮原子是sp2杂化。由于SO2分子中,S原子含有2对孤对电子,所以SO2是V形结构。
(4)根据晶胞的结构可知,含有的氮原子是8×1.8=1,而含有的铜原子是12×1/4=3,所以该化合物的化学式是Cu3N。
