(11分)元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置 ; D的最高价氧化物的水化物的化学式为______。
(2)E的气态氢化物在同族元素中沸点最高的原因是: 。
(3)A、C两元素第一电离能前者 后者(填“大于”或“小于”)。无论是A和C的单质还是A和C的氢化物的固体,均能与水剧烈反应生成气体,当上述四种固体分别与足量水反应时,满足n(消耗固体):n(气体):n(转移电子)=1:1:1关系的反应的化学方程式_______________。
(4)B元素能形成多种配合物,如B2+可与NH3形成配离子[B(NH3)4]2+。其配体的空间构型为 ;右图表示B与某种元素X形成的化合物晶胞,如果该化合物中B和X通过离子键结合,该晶体中阳离子的配位数为 。若B和X通过共价键结合,则该化合物的化学式为 (a ZnX b ZnX2 c ZnX3)
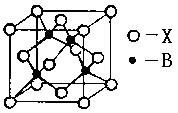
(5)A和E可形成离子化合物,其晶胞结构如图示。该化合物的电子式_______。则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是_______。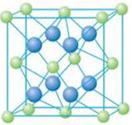
(1)第4周期第IIB族 HBrO4
(2)E的气态氢化物分子间含有氢键,破坏它需要较高的能量,所以熔沸点较高
(3)大于、KH+H2O=KOH+H2↑(2分)
(4)三角锥形 4 a (5)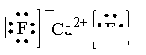 正方体
正方体
根据元素的结构及其性质可知,A、B、C、D、E、5种元素分别是Ca、Zn、K、Br、F。
(1)锌位于元素周期表的第4周期第IIB族。溴的最高价是+7价,所以最高价氧化物的是水化物的化学式为HBrO4。
(2)HF分子间含有氢键,破坏它需要较高的能量,所以熔沸点较高。
(3)金属性越强,第一电离能越小,所以钙的第一电离能大于钾的。满足n(消耗固体):n(气体):n(转移电子)=1:1:1,说明该元素的化合价是+1价,所以是KH,方程式为KH+H2O=KOH+H2↑。
(4)氨气是三角锥形结构。通过离子键结合,则铜是阳离子。所以根据晶胞结构可知,该晶体中阳离子的配位数为4;若B和X通过共价键结合,则根据晶胞结构可知,含有碳原子是4个,X是8×1/8+6×1/2=4,所以答案选a。
(5)A和E形成离子化合物CaF2,其电子式为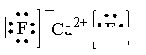 。蓝球不是钙离子,所以根据晶胞结构可知,晶胞中与钙离子距离相等且最近的E离子共计是8个。围成的几何体形状是正方体。
。蓝球不是钙离子,所以根据晶胞结构可知,晶胞中与钙离子距离相等且最近的E离子共计是8个。围成的几何体形状是正方体。
