(13分)试根据上表填空:
| A | ||||||||||||||||||
| B | C | D | E | F | ||||||||||||||
| G | H | I | J | L | K | M | ||||||||||||
| N | Q | |||||||||||||||||
(2)基态D原子核外有 个未成对电子;D2分子中分别有 个, 个π键。
(3)化合物DA5中既含离子键,又含共价键和配位键,请写出它的电子式 。
(4)表四中的元素能形成XY2型的共价分子有CE2、CL2、BK2、LE2四种,其分子的空间构型中有一种与其他三种不同,它是 (填化学式);而形成XY3型的共价分子也有四种,它们分别是DA3、DF3、DK3、LE3,其分子的空间构型中也有一种与其他三种不同,它是 (填化学式),它是由_ 键(填“极性”或“非极性”,下同)构成的 分子。
(5)第三周期8种元素按单质熔点高低的顺序如右图所示,其中序号“8”所代表的元素是 (填元素符号);其中气态氢化物稳定性最强的元素是 (填下图中的序号)。

(6)科学家证实,IK3属于共价化合物,分子式为I2K6,其结构式为下列四种中的一种,你认为正确的结构式是____________。

(7)向Q的硫酸盐溶液中加入足量的DA3的水溶液过程中,请写出发生反应的离子方程式 ;最后生成配离子的结构式为 。
(1)(2分)1s22s22p63s23p63d104s1; (2分)第4周期 VIII族。
(2)(3分) 3; 1 , 2。(3)(2分) 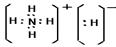 。
。
(4)(4分) SO2; SO3 ; 极性; 非极性
(5)(2分) Si 、 2 ;(6)(2分) ③ 。
(7)(6分)Cu2++2NH3•H2O= Cu(OH)2↓+2NH4+
Cu(OH)2 +4NH3 =〔Cu(NH3)4〕2+ + 2OH-。
(1)Q是铜,根据构造原理可知,电子排布式为1s22s22p63s23p63d104s1。N是铁元素,位于第4周期VIII族。
(2)D是氮元素,最外层有3个未成对电子。氮气是由三键构成的,而三键是由2个π键和1个σ键构成。
(3)化合物DA5是氢化铵,属于离子化合物。电子式为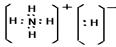 。
。
(4)CE2、CL2、BK2、LE2四种物质分别是CO2、CS2、BeCl2、SO2,其中前三个是直线型化合物,SO2是V形结构。DA3、DF3、DK3、LE3四种物质分别是NH3、NF3、NF3、SO3。其中SO3是平面三角形,是由极性键形成的非极性分子,其余都是三角锥形。
(5)硅是原子晶体,熔点最高。氯元素的非金属性最强,氯化氢最稳定。单质氯的沸点之比Ar的高,是由是2。
(6)氯元素最外层含有孤对电子,能和铝元素形成配位键,所以正确的答案是③。
(7)硫酸铜和氨水发生复分解反应,生成氢氧化铜沉淀。当氨水过量时,由于氨气能和铜离子形成配位键,所以沉淀会溶解,生成配合物。反应式为Cu2++2NH3•H2O= Cu(OH)2↓+2NH4+、Cu(OH)2 +4NH3 =〔Cu(NH3)4〕2+ + 2OH-。
