( 12分)有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了 。
(4)G位于 族,G3+价电子排布式为 。GE3常温下为固体,熔点 ,沸点
,沸点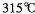 ,在
,在 以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
(5)DE3 中心原子的杂化方式为 ,其空间构型为 。
(6)前四周期中与F同一族的所有元素分别与E元素形成化合物,其晶体的熔点由高到低的排列顺序为(写化学式) ,原因是
(12分)(1)NH4+ H- (1分)(2) 3 ,纺锤形(各1分,共2分)
(3)泡利原理 (1分)(4) 第Ⅷ ,3s23p63d5 ,分子晶体(各1分,共3分)
(5) sp3,三角锥 (各1分,共2分)
(6)LiCl>NaCl>KCl>HCl,LiCl、NaCl、KCl均为离子晶体,HCl为分子晶体,所以HCl熔点最低。又因为Li+、Na+、K+的半径依次增大,LiCl、NaCl、KCl的晶格能依次减小,故熔点依次降低。(1分+2分)
题目分析:宇宙中最丰富的元素是H,所以A是氢元素;B元素原子的核外p电子数比s电子数少1,所以根据构造原理可知,B应该是N;C元素的第三电离能远大于第而电离能,所以C是第ⅡA元素,根据原子序数可知,C是Mg;D原子核外所有p轨道全满或半满,则D是P;E元素的主族序数与周期数的差为4,且原子序数大于15,所以E是氯元素;F是前四周期中电负性最小的元素,由于金属性越强,电负性越小,所以F是K;G在周期表的第八列,且属于第四周期,所以G是铁元素。
(1)由于BA5 为离子化合物,所以是由NH4+、 H-两种微粒构成。
(2)B基态原子中能量最高的电子是2p3电子,其电子云在空间有3个方向,原子轨道呈纺锤形。
(3)1个原子轨道里最多容纳2个电子,且自旋方向相反这就是泡利原理。所以根据电子排布图可知,违反了泡利原理。
(4)铁位于第Ⅷ族,根据构造原理可知铁离子的价电子排布式为3s23p63d5。根据氯化铁的熔沸点较低、易升华及溶解性可知,该化合物形成的晶体应该是分子晶体。
(5)三氯化磷中中性原子P原子含有的孤对电子对数是(5-1×3)÷2=1,所以是三角锥形结构,属于sp3杂化。
(6)由于LiCl、NaCl、KCl均为离子晶体,而HCl为分子晶体,所以HCl熔点最低。又因为Li+、Na+、K+的半径依次增大,即LiCl、NaCl、KCl的晶格能依次减小,所以熔点依次降低,即正确的顺序是LiCl>NaCl>KCl>HCl。
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
