(15分)砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)基态砷原子的电子排布式为_______________,砷与溴的第一电离能较大的是______.
(2)AsH3是无色稍有大蒜味气体.AsH3的沸点高于PH3,其主要原因是
________________________________________________.
(3)Na3AsO4可作杀虫剂.AsO43-的空间构型为_____________,与其互为
等电子体的一种分子为______________.
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示,该化合物的分子式为__________,As原子采取_______杂化.
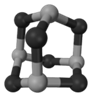
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与_______个Ga相连,As与Ga之间存在的化学键有_____________(填字母)。
A.离子键
B.氢键
C.配位键
D.金属键 E.极性键
(1)[Ar]3d104s24p3(2分) Br(或溴)(1分)
(2)AsH3的相对分子质量大于PH3的相对分子质量,故AsH3分子间作用力大于PH3分子间作用力(2分)
(3)正四面体形(2分) CCl4(或其他合理答案)(1分)
(4)As4O6(2分) sp3(2分) (5)4(1分) C E(2分)
(1)根据构造原理可知,基态砷原子的电子排布式为[Ar]3d104s24p3。非金属性越强,第一电离能越大,所以溴的第一电离能大于砷的。
(2).AsH3和PH3形成晶体都是分子晶体,其沸点高低与分子间作用力强弱有关系。由于AsH3的相对分子质量大于PH3的相对分子质量,故AsH3分子间作用力大于PH3分子间作用力,所以AsH3的沸点高于PH3的。
(3)根据AsO43-的结构可知,其空间构型是正四面体。等电子体是指价电子数和原子数分别都相等的物质。AsO43-中价电子数是5+6×4+3=32,所以与其互为等电子体的是四氯化碳。
(4)根据砒霜的分子结构图可知,分子式为As4O6,由于化学键都是单键,所以是sp3杂化。
(5)晶体结构与金刚石相似,所以GaAs晶体中,每个As与4个Ga相连。As与Ga之间存在的化学键是极性键,由于Ga的价电子是3个,所以还存在配位键,答案选CE。
