(10分)
(1)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体易溶于水,则此种化合物是 (填“极性”、“非极性”)分子。
(2)今有A、B、C、D四种元素,它们的原子序数依次增大,且均小于18,A和B在同一周期,A原子p能级有一个空轨道,B原子的p能级有两个未成对电子,0.1mol C单质能从酸中置换出 2.24L氢气(标准状态),此时它就变成与B离子电子层排布完全相同的离子。D离子的半径在B、C、D中为最小。则:
①A是_________,B是_________,C是_________,D是__________。(填名称)
②A单质和B单质充分反应生成的化合物的电子式是____________。
③我国科学工作者于20世纪90年代在兰州制备出过去一直依赖进口,价格十分昂贵的B的一种同位素形成的单质,1mol这种单质中含中子的物质的量是20mol,则这种同位素原子的符号为________。
(3)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl。CoCl3·5NH3中Co化合价为 ,请写出表示此配合物结构的化学式: 。
(4)核内中子数为N的R2+,质量数为A,则ng它的氧化物中所含质子的物质的量是
。
(1)极性 (2)①碳 氧 镁 铝 ②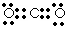 ③
③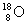
(3)+3 [Co(NH3)5Cl]Cl2 (4)n(A-N+8)/(A+16) mol
(1)由于水是极性分子,所以根据相似相溶原理可知,该化合物是极性分子。
(2)①A原子p能级有一个空轨道,所以A是C或Si,由于0.1mol C单质能从酸中置换出 2.24L氢气(标准状态),所以C是金属,因此根据原子序数可知,A是C。B原子的p能级有两个未成对电子,所以B是O。则C是Mg。D离子的半径在B、C、D中为最小,所以D是Al。
②C和O充分反应的生成物是CO2,含有极性键的共价化合物,所以电子式为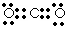 。
。
③1mol单质中含中子的物质的量是20mol,所以1个氧原子中含有10个中子,则符号是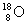 。
。
(3)氯元素的化合价是-1价,所以根据化合价代数和为0可知,Co的化合价是+3价。每1molCoCl3·5NH3只生成2molAgCl,说明只有1个氯离子是配体,所以化学式为 [Co(NH3)5Cl]Cl2 。
(4)核内中子数为N的R2+,质量数为A,则质子数是(A-N),氧化物的化学式是RO,所以ng它的氧化物中所含质子的物质的量是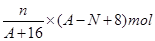 。
。
