(13分) 下表为元素周期表的一部分,其中编号代表对应的元素。

请回答下列问题:
(1)写出元素⑦的基态原子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的轨道表示式为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素④和⑥的第一电离能大小顺序是 > (用元素符号表示)。请写出由④和⑤两种元素形成的与N3-互为等电子体的离子的化学式 ,其VSEPR构型为 。
(4)在测定①和⑥形成的化合物的相对分子质量时,实验测得值一般高于理论值,其主要原因是 。
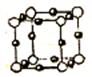
(5)④和⑧形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中④显-3价),则其化学式为 。
⑧的常见离子和④的最简单氢化物形成的配离子的名称为 ,
其水溶液颜色为 。
(1)1s22s22p63s23p63d54s1(1分) ds (1分) (1分)
(1分)
(2)sp2和 sp3(1分)
(3)F > N (2分);NO2+(1分),直线形(1分)
(4)HF分子间存在氢键,易形成缔合分子(HF)n (2分)
(5)Cu3 N (1分);四氨合铜离子(1 分), 或其它合理答案);深蓝色(1分)
根据元素在周期表中的位置可知,①~⑧分别是H、Be、C、N、O、F、Cr、Cu。
(1)根据构造原理可知,Cr的基态原子排布式为1s22s22p63s23p63d54s1。区的名称来自于按照构造原理最后填入电子能极的轨道名称,所以根据构造原理可知,Cu位于ds。同样根据构造原理可知,氧原子的价层电子的轨道表示式为 。
。
(2)化合物对氢气的相对密度为23,则相对分子质量是46。又因为H、C、O三种元素的质量比为1:6:16,所以化学式为CH2O2,即是甲酸,结构简式为HCOOH。其中碳原子是sp2杂化,两个氧原子,一个是sp2杂化,另一个是sp3杂化。
(3)非金属性越强,第一电离能越大,所以F的第一电离能大于N的。价电子数和原子数分别都相等的是等电子体,所以有N和O形成的与N3-互为等电子体的离子的化学式为NO2+。其中氮原子含有的孤对电子对数是(5-1-2×2)÷2=0,所以是直线型结构。
(4)由于HF分子间存在氢键,易形成缔合分子(HF)n,所以测得值偏高。
(5)根据晶胞结构可知,含有氮原子是8×1/8=1,铜原子是12×1/4=3,所以化学式为Cu3 N。铜离子和氨气通过配位键形成四氨合铜离子,溶液显深蓝色。
