碳、氮、氧是地球上丰富的元素。
(1)C、N、O的第一电离能由大到小的顺序为(用元素符号表示)_________。
(2)前四周期元素中,基态原子未成对电子数与氮相同的元素有_________种。
(3)试判断NH3溶于水后,形成NH3·H2O的合理结构:_______(填字母代号),推理依据是____ ___________。
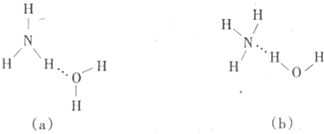
(4)H2O分子与H+结合的过程中未发生改变的是_________(填序号)。
a.微粒的空间构型 b.O原子的杂化方式 c.H—O—H的键角
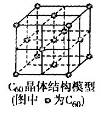
(5)C60晶体(其结构模型如图)中每个C60分子周围与它距离最近且等距离的C60分子有__________个。
(8分)(1)N、O、C(1分) (2)4(2分)
(3)b(1分);一水合氨电离产生NH4+和OH-(1分) (4)b(1分) (5)12(2分)
题目分析:(1)同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以C、N、O的第一电离能由大到小的顺序为N>O>C。
(2)氮元素核外电子排布是1s22s22p3,所以基态原子未成对电子数是3个,因此前四周期元素中,基态原子未成对电子数与氮相同的元素有P、V、Co、As,共计是4种元素。
(3)因为一水合氨在溶液中能电离产生NH4+和OH-,因此在其结构中氮元素与水中的氢元素形成氢键,所以正确的结构是b,答案选b。
(4)H2O分子与H+结合形成水合氢离子,其空间构型由V形变为三角锥形,因此微粒的空间构型、H—O—H的键角均发生变化,但O原子的杂化方式不变,仍然是sp3杂化,答案选b。
(5)根据C60晶胞结构可知,每个C60分子周围与它距离最近且等距离的C60分子位于面心处,共计有3×8÷2=12个。