(12分)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
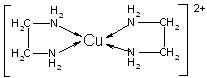
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为 ,
H、N、O三种元素的电负性由大到小的顺序是 ;
(2)SO2分子的空间构型为 ;
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)配离子[Cu(En)2]2+的配位数为 ,该微粒含有的微粒间的作用力类型有 (填字母);
A.配位键
B.极性键
C.离子键
D.非极性键E.氢键 F.金属键
(5)CuCl的晶胞结构如右图所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为 。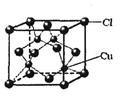
(1)3d9(1分);O>N>H(1分) (2)V型(1分);
(3)sp3杂化(1分);乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键(2分)
(4)4(2分); ABD(2分) (5)4(2分)
(1)根据构造原理可知,铜离子的基态外围电子排布式为3d9。非金属性越强,电负性越大,即电负性大小顺序是O>N>H。
(2)根据价层电子对互斥理论可知,SO2中S原子含有的孤对电子对数是(6-2×2)÷2=1,所以SO2是V型结构。
(3)乙二胺分子中氮原子形成的全部是单键,因此是sp3杂化。由于乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,所以前者的沸点高于后者。
(4)根据结构式可知,配离子[Cu(En)2]2+的配位数为4,含有的作用力是ABD。
(5)根据晶胞结构可知,与Cl-最近距离的Cu+的个数是4个,恰好构成正四面体。
