(12分,每空2分)
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
①请根据上述信息,写出A基态原子的核外电子排布式:__________________。
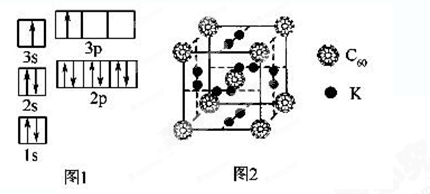
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了______________________。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中C—C键的键长为154.45 pm,C60中C—C键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由____________________________ ________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为______________________。
③继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是__________ 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______。
(1)①1s22s2 ②能量最低原理 (2)①不正确,C60是分子晶体,熔化时不需破坏化学键
②3∶1 ③N>C>Si 30
(1)表中A、B两原子的第二、三电离能之间都有1个突跃,说明它们属于ⅡA族,又它们都是短周期元素,且A的第一电离能比B大,因此,A为Be元素,核外电子排布式是1s22s2。B为Mg元素。图1所示电子排布,根据能量最低原理,最外层两个电子应全排在s轨道上。,违背能量最低原理。
(2)①由于C60是分子晶体,金刚石是原子晶体,熔化时前者需破坏分子间作用力,后者相应破坏化学键,所以是错误的。
②K原子和C60分子的个数比为(12÷2)∶(8÷8+1)=3∶1。
③非金属性越强,电负性越大,所以电负性由大到小的顺序是N>C>Si。根据题意,每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构。显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30。
