( 8分)原子序数小于36的X、Y、Z、W四种元素,其中X形成的阳离子就是一个质子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,
1mol Y2X2含有σ键的数目为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 。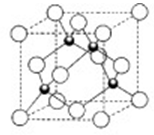
(共8分,每空2分)(1)sp1杂化 3NA或3×6.2×1023个
(2)NH3分子存在氢键 (3)CuCl
根据元素原子的结构及应该性质可知,X、Y、Z、W四种元素分别是H、C、N、Cu。
(1)乙炔是直线型分子,所以碳原子是sp1杂化;单键都是σ键,而三键是由1各σ键和2个π 键形成,所以根据乙炔的结构式可知,1mol乙炔分子中含有σ键的数目为3NA个。
(2)由于氨气分子中存在氢键,所以沸点高于甲烷的沸点。
(3)根据晶胞的结构可知,该晶胞中含有氯原子的个数是4个,而铜原子是8×1/8+6×1/2=4,所以化学式是CuCl。
