“物质结构与性质”模块(10分)
请回答下列问题:
(1)N、AI、Si、Zn四种元素中,有一种元素的电离能数据如下:

(2)则该元素是__①___(填写元素符号)。Zn原子的电子排布式是__②__。Ce的最高价氯化物分子式是_ __③___。该元素可能的性质或应用有__④___。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
关于化合物 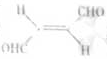 ,下列叙述正确的有 ⑤ 。
,下列叙述正确的有 ⑤ 。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个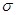 键和1个
键和1个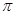 键
键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF的熔点 ⑥ 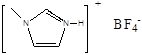 的熔点(填>、<或=),其原因是 ⑦
的熔点(填>、<或=),其原因是 ⑦
①AI
②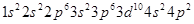
③
④C、D
⑤B、D
⑥>
⑦两者均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低
(1)该元素在第四电离能发生突变,该元素为正三价,为铝元素;根据能量最低原理和核外电子排布规律不难写出电子排布式;Ge和C为同族元素,Ge最高价为+4价,氯化物分子式为GeCl4。Ge位于金属和非金属分界线附近,既具有金属性,也具有一定的非金属性,可作为半导体材料;Ge不是一种活泼的金属;Ge为金属,电负性要小于硫;Ge的氯化物和溴化物均为分子晶体,相对分子质量越大,分子间作用力越大,Ge的溴化物沸点更高。
分子中含有碳碳非极性共价键,也含有碳氢极性共价键,B项正确;分子中含有4个 C-H和3个
C-H和3个 C-C 和2个
C-C 和2个 C-O,3个π键,1个πC=C和2个πC=O ;该分子中含有两个醛基,溶解度要大于2-丁烯。
C-O,3个π键,1个πC=C和2个πC=O ;该分子中含有两个醛基,溶解度要大于2-丁烯。
(4)两者均为离子化合物,晶格能越大,熔点越高;两者阴阳离子电荷数均为1,但后者的离子半径较大,晶格能小,因此其熔点较低。
【考点定位】本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、化学键类型等知识,具有一定的难度。
