已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出F元素的电子排布式_______。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______。
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
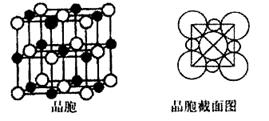
晶胞中距离一个Na+最近的Na+有____________个。若晶体密度为ρ g·cm-3,阿伏加德罗常的值用NA表示,则Cl-的离子半径_____cm(用含NA与ρ式子表达)。
(1)[Ar]3d54s1
(2)sp3
(3)三角锥形
(4)Cl> P> S>Na NaOH > H3PO4>HClO4>H2SO4
(5)12 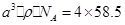
试题解析:A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等,则基态A原子的核外电子排布为1s22s22p4,A为O;B是短周期中原子半径最大的元素,则B为Na;C元素3p能级半充满,则基态C原子的核外电子排布为1s22s22p63s23p3,C为P;F在第四周期,且F的原子序数大于E,E又是所在周期电负性最大的元素,则E在第三周期,E为Cl;D的原子序数大于C且小于E,则D为S;F是第四周期未成对电子最多的元素,则基态F原子的核外电子排布为1s22s22p63s23p63d54s1,则F为Cr。
(1)基态F原子的核外电子排布为1s22s22p63s23p63d54s1,或[Ar]3d54s1。
(2)A的一种氢化物含有4个原子,该氢化物为H2O2, O最外层共有4对电子,在空间有4个伸展方向,故轨道杂化类型为sp3。
(3)P、Cl形成PCl3、PCl5两种化合物,其中PCl3是极性分子,中心原子P的最外层5个电子,有3个分别与3个Cl形成共用电子对,还剩余一个孤电子对,因此P的杂化方式为sp3,而PCl3的分子构型与NH3相似,是三角锥型。
(4)同一周期元素,第一电离能自左向右有增大的趋势,但因P的3p轨道处于半充满状态,比较稳定,因此第一电离能P>S。相同浓度的四种溶液,硫酸是二元强酸,溶液中c(H+)最大,故pH最小,H3PO4是中强酸,不能完全电离出H+,酸性比HClO4弱,因此pH大于HClO4。
(5)在NaCl晶胞中,距离一个Na+最近的Na+有12个,分别在x、y、z三个方向平面的四个顶点。
每个NaCl晶胞中含有4个NaCl,设晶胞的棱长为a cm,则有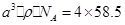 ,a=
,a=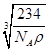 。Cl-的半径大于Na+的半径,根据晶胞截面图,可知晶胞截面的对角线长为Cl-半径的4倍,面对角线长为
。Cl-的半径大于Na+的半径,根据晶胞截面图,可知晶胞截面的对角线长为Cl-半径的4倍,面对角线长为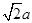 ,故Cl-的半径为
,故Cl-的半径为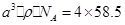 。
。
