卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为 。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为 。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于 。
(4)互为等电子体的微粒相互之间结构相似。I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 ,中心原子杂化类型为 。
(5)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为 (填序号)。
(6)卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式 。
(7)如图所示为卤化物冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 。

(15分)(1)4s24p5(2分) (2)IBr>ICl>Cl2(2分) (3)HF分子间形成氢键 (2分)
(4)V形(或角形);sp3(各1分,共2分) (5)①>②>③(2分) (6)RbCl(2分)
(7)●:AlF6- ; ○:Na+ ;AlF6-(各1分,共3分)
题目分析:(1)溴元素的原子序数是35,所以根据构造原理和能量最低原理可知,基态溴原子的价电子排布式为4s24p5。
(2)卤素单质形成的晶体均是分子晶体,分子间作用力越大,沸点越高。则Cl2、IBr、ICl沸点由髙到低的顺序为IBr>ICl>Cl2。
(3)由于F的电负性最大,因此HF分子中存在氢键,从而形成二聚分子。
(4)因为I3+可看成II2+,所以根据价层电子对互斥理论可知,I3+中中心原子含有的孤对电子对数=(7-1-2×1)÷2=2,所以其空间构型为V形,其中I原子的杂化轨道类型是sp3杂化。
(5)由于非金属性Cl>Br>I,非金属性越强,则对应的最高价氧化物的酸性越强,则①的酸性最强。在②③中都是碘元素的含氧酸,非羟基氧个数越多,酸性越强,则酸性为②>③,故三种物质的酸性由强到弱的顺序为①②③。
(6)RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,氯离子的半径小于碘离子的半径,则RbCl的离子键长小于RbI的离子键长,则RbCl的晶格能较大,所以则A为RbCl。
(7)根据晶胞结构并依据均摊法可知,●表示的微粒个数=8× +6×
+6×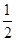 =4个,○表示的微粒个数=12×
=4个,○表示的微粒个数=12×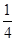 +8=11。根据化学式可知,Na+和AlF6-的个数比是3:1,则白 * * 和黑 * * 之比接近3:1,要满足3:1,则▽所代表的应该是AlF6-。
+8=11。根据化学式可知,Na+和AlF6-的个数比是3:1,则白 * * 和黑 * * 之比接近3:1,要满足3:1,则▽所代表的应该是AlF6-。
