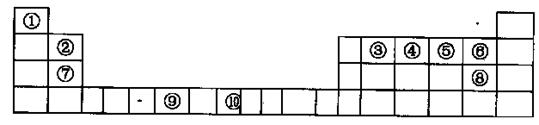
下表为长式周期表的一部分,其中的序号代表对应的元素。
(1)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为 杂化,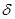 键与
键与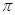 键的个数比为 。
键的个数比为 。
(2)元素③、④、⑤、⑥的第一电离能由大到小的顺序为 。其中⑥元素核外电子的电子排布图为 。
(3)③元素形成的最高价氧化物所形成的晶胞边长为acm,则其晶胞密度为 ;
(4)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,还原产物没有气体,该反应的离子方程式为 。
(5)元素③与⑤形成的原子个数比为1:1化合物能与⑩的单质形成形式为A(BC)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,其晶体类型 ,该配合物在一定条件下分解生成⑩的单质和③与⑤形成的原子个数比为1:1化合物,则在分解过程中破坏的化学键为 ,形成的化学键为 。
(6)化学上有一种见解,认为同种元素形成的含氧酸中该成酸元素的化合价越高,酸性越强,请用表中的元素举例说明(酸性由强到弱的顺序) 。
(1)sp2;(1分) 5:1(1分)
(2)F>N>O>C (1分)  (2分)
(2分)
(3)176/a3NA g/cm3(2分)
(4)4Mg+10H++NO3-=4Mg2++NH4++3H2O (3分)
(5)分子晶体;(1分)配位键;(1分)金属键(1分)
(6)HNO3>HNO2或者HClO4>HClO3>HClO2>HClO(写出部分也给分)(2分)
题目分析:图表为元素周期表中前四周期元素,按照1——10顺序分别是H、Be、C、N、O、F、Mg、Cl、Cr、Fe(1)③与①形成乙烯,其中碳元素形成碳碳双键,sp2杂化;(2)第一电离能F最强,由于N原子p轨道上半充满,比较稳定,比O强,C原子最小,F>N>O>C ;(3)CO2晶胞是面心立方晶体,其中有4个分子,密度为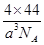 ;(4)镁与硝酸发生氧化还原反应,无气体生成,说明硝酸被还原为铵盐,得4Mg+10H++NO3-=4Mg2++NH4++3H2O;(5)A(BC)5是Fe(CO)5, 该配合物常温下为液态,熔点低,易溶于非极性溶剂,是分子晶体。
;(4)镁与硝酸发生氧化还原反应,无气体生成,说明硝酸被还原为铵盐,得4Mg+10H++NO3-=4Mg2++NH4++3H2O;(5)A(BC)5是Fe(CO)5, 该配合物常温下为液态,熔点低,易溶于非极性溶剂,是分子晶体。
